
Enkle tekniske eksperimenter er meget nyttige at gøre med børn, dette er at tilbringe tid sammen, indpasse færdigheder og forståelse hos små designere, det grundlæggende, at brødene, som i den berømte tegneserie, ikke vokser på træer.
Denne gang besluttede vi at fremstille den enkleste kemiske strømkilde og prøve at anvende den til noget praktisk. Når vi taler om den praktiske anvendelse, er det værd at minde om, at for bare et par generationer siden blev radioamatører til at levere deres batteriradiomodtagere og -forstærkere tilbudt at fremstille flere typer galvaniske celler eller batterier til uafhængig produktion. Dette er elementerne i Leklanshe og Popov [1] s. 9 ... 18 eller et blypotash eller gasbatteri [1], s. 22 ... 28. Flere, relativt højstrømselementer var forbundet til et glødende batteri (glødetråd af radiorør), snesevis af mindre elementer, til et anodebatteri, hvis spænding kunne nå 60-80 volt. Batterierne var "våde" - med flydende elektrolyt og krævede pleje og vedligeholdelse.
således galvanisk celle, et par ord "hvordan?" og "hvorfor?" Elektrisk strøm opstår, når metaller interagerer. I dette tilfælde opstår der en anden potentialeforskel (spænding). Tilbage i 1793 etablerede Alessandro Volta ved konstruktion af en galvanisk celle (Volta-pol) den relative aktivitet af de daværende kendte metaller: Zn, Pb, Sn, Fe, Cu, Ag, Au. "Styrken" af den galvaniske celle viste sig at være større, jo længere fra hinanden stod metallerne i denne række (spændingsserien).

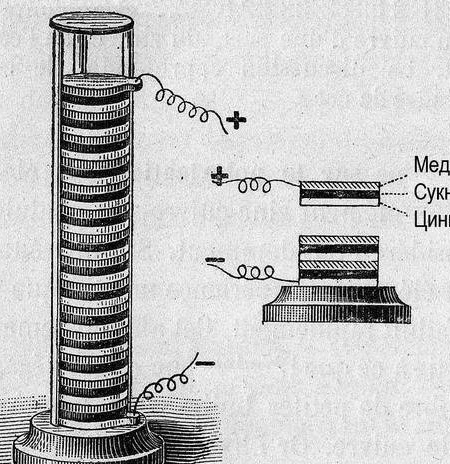
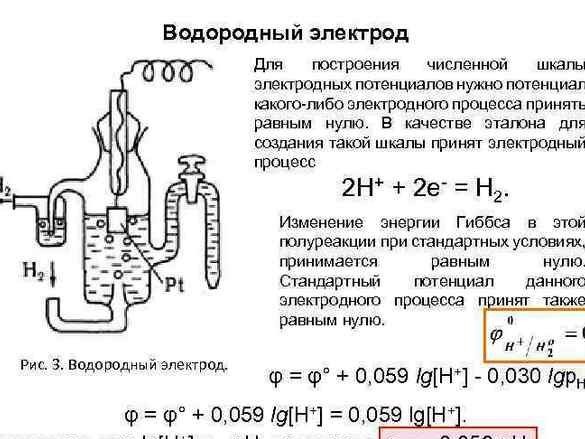
Senere, for at organisere dataene, blev potentialet for "brintelektrode" taget som en nulreference. Efter at have målt potentialet af metaller parret med ham, blev de eksperimentelle metaller arrangeret i træk. Den resulterende tabel blev kaldt "Elektrokemisk række af metalspændinger" og skal i kemi-rummet hænge ved siden af det periodiske system og portræt af Dmitry Ivanovich.

Et antal metalspændinger er en nyttig kontrast, i vores tilfælde vil vi ligesom Alessandro Volta vide - jo længere metaller er adskilt fra hinanden, jo større er spændingen.
I vores eksperimenter, som klassikere, brugte vi kobber og zink.Når pladerne nedsænkes i en elektrolyt mellem den og zinkpladen, opstår der en kemisk reaktion, som et resultat af hvilke negative ladninger samler sig på pladen, og den lades negativt. Som et resultat af reaktionen, der finder sted i den galvaniske celle, opløses zinkelektroden gradvist.
På en kobberelektrode dannes under driften af en galvanisk celle, små hydrogebobler, der isolerer overfladen af kobber fra elektrolytten. Fænomenet kaldes, i en galvanisk celle er det skadeligt, de kæmper med det. For at fjerne det frigjorte brint indføres stoffer kaldet brint i elektrolytten. I deres rolle er ofte forbindelser af mangan, kobbersulfat. I enkle eksperimenter kan apotekskaliumpermanganat anvendes.
Hvad vi brugte til eksperimentet.
Enheder og materialer.
Til samling af galvaniske celler, som kobberelektroder, kan du bruge wire, wire, folie. Zink kan udvindes fra tørre elementer, galvaniserede produkter kan bruges. I stedet for zink kan du prøve at bruge en elektrode af aluminium eller jern. Natriumchlorid til elektrolyt, lidt blød monteringstråd. Du har bestemt brug for et voltmeter eller multimeter, trådskærer, saks. Som beholdere kan der anvendes ikke-metalliske containere af en passende størrelse. Glas, mere praktisk end lette plastikbægre - de er tungere, mere stabile, vanskeligere at slå over. Det er meget godt, hvis der er en lavstrøm lavspændingsbelastning - en simpel radio, et kvartsur osv.
"Højspændings" batteri af ledninger og skruer.
Fascineret af enkeltheden af detaljerne og den relativt høje spænding, vi modtog, forsøgte vi at samle et sådant batteri. Her bruges et “klassisk” par metal - kobber-zink. Tanken er at bruge galvaniserede fastgørelseselementer som en zinkelektrode. Yndefuldt. Det er tydeligt, at et sådant element ikke er designet til langvarig drift - et tyndt lag af zink vil hurtigt opløses, men dette er ikke vigtigt for et kortvarigt eksperiment. Men galvaniserede skruer eller tandhjul er overalt fyldige.
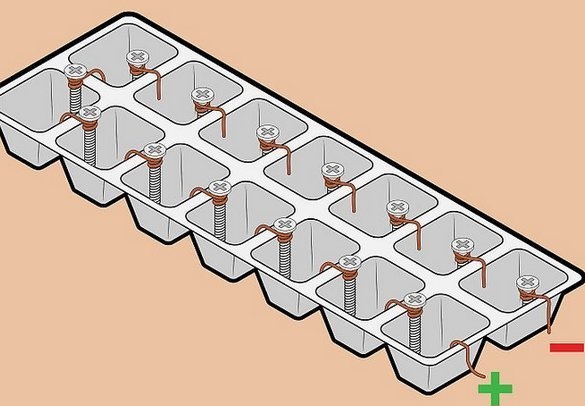
En ledning bruges også som en kobberelektrode - også et bredt tilgængeligt materiale, derudover - den mest praktiske installation af elementer i et batteri - alle elementer er forbundet i serie - plus et til minus til det næste. I dette tilfælde summeres spændingen, strømmen forbliver den samme.
Lad os komme i gang.
Efter at have valgt det krævede antal galvaniserede fastgørelseselementer med den ønskede længde, fandt vi en passende kobbertråd. Dette er en viklet ledning i lakisolering. Trådens diameter er ca. 0,5 mm.

Pole renser lakisolering flere gange med indsats for at trække ledningen gennem en dobbelt foldet slibeskind af mellemstor størrelse.


Derefter forbereder han et par elektroder - under hovedet på en selvskærende skrue, pakkes to eller tre ledninger tæt sammen og skærer overskydende af.

Batterisamling - et trug blev brugt som en beholder til frysning af is. Du kan bruge celler fra boksede slik, men de er mere subtile. Efter installation af elektroderne på væggene mellem cellerne fylder vi beholderne med elektrolyt. Vi brugte en opløsning af bordsalt - en spiseskefuld med et objektglas på 0,5 liter varmt vand. Til påfyldning er det meget praktisk at bruge en medicinsk sprøjte.


Vi fandt endnu et par skruer til elektroderne og føjede elementer til batteriet, det er hvad vi fik. Spændingen ved en højimpedansbelastning (indgangsmodstand for et digitalt voltmeter) er betydelig, men ved enhver belastning, uanset hvor mærkbar den falder markant.
Prøv at gøre lignende galvanisk celle (batteri) med større elektroder.
Som en container brugte vi en halv liters krukke (to), plader med et betydeligt område vil passe ind i det. Som elektroder tog vi tynd kobberfolie og zink - resterne af et glas fra et "tørt" element fra fabrikken, der blev adskilt under produktionen af grafit til ildfast belægning.

Vi rensede resterne af tørrede krystallinske salte med en trådbørste og skar to plader med omtrent saks med omtrent det samme område. Klip to matchende striber fra kobberfolie. Også med saks. Vi fik to par elektroder, som udstyrede vores elementer uden yderligere at bøje deres kanter på halsen af dåsen.


I en større beholder forberedte de en elektrolyt - natriumchlorid, opløst i varmt vand, koncentrationen er den samme, og forberedte elementer hældes.


Vi forbandt de to elementer i serie ved hjælp af et stykke af monteringswiren og to krokodilleklemmer. Så fint, batterispændingen er tæt på standard "fingeren", prøv at bruge. Et element med en spænding på 1,5 V bruges i et elektromekanisk ur, derudover er urets strømforbrug meget lille, og vores batteri vil være i stand til at overmanne det.

Vi fjernede standardbatteriet fra uret og tilsluttede et stykke af monteringsledningen til klemmerne. Iagttagelse af polariteten (kobberplade - "+", zink - "-") sluttede vores ur til et provisorisk batteri, voila! Uret fungerer, spændingen "synker" til 1,3 V. Uret fungerede perfekt i flere timer, indtil vi alle pralede (dog en troldmand!) Så blev vi trætte.

Til banen.
Ethvert barns interne forfatning er sådan, at opmærksomheden omkring et emne, han er i stand til at fokusere ikke mere end 15 ... 20 minutter, og alle klasser med børn skal planlægges, så de passer ind på det tidspunkt, eller skifte mellem forskellige klasser, ellers bliver du begge plaget.
Som en belastning er det bedre at anvende det, uanset om det er bevægende eller lysende - numrene på voltmeteret imponerer sindet, men ikke hjertet. Ud over ure og regnemaskiner vil det helt sikkert medføre beundring, arbejdet fra et hjemmelavet batteri fra en lille radiomodtager (som ekstraudstyr - en hjemmelavet en!).
Ved langvarig brug skal cellernes elektrolyt beskyttes mod støv og fordampning og passe på depolarisatoren - ja, i det mindste tilstoppe beholderen med et stykke plastfolie med et elastisk bånd og tilsætte kaliumpermanganat til elektrolytten. Derudover er det bedre at straks samle det nævnte element af Popov.
Ud over galvaniserede selvskærende skruer er det muligt at bruge galvaniseret pladestål, for store elementer er det mere praktisk - under eksperimentet kan du få en betydelig strøm og kraft uanset (at bevæge fingrene i luften).
Liste over brugt litteratur.
1. P. Strelkov. Kend og være i stand. Pioneer elektrisk ingeniør. Detgiz. 1960 år
2. V.S. Polosin, V. G. Prokopenko. Workshop om metodologi til undervisning i kemi. Moskva, "Oplysning", 1989, s. 202,203.

